Daratumumab投与中のIgG-κ型多発性骨髄腫患者の治療効果判定におけるDIRA検査 |
|
モノクローナル抗体薬であるdaratumumab (IgG-κ型)は,多発性骨髄腫患者における有効で安全な治療薬として欧米のガイドラインで推奨されている。我が国においても移植非適応の未治療患者ならびに再発難治性患者に対し保険適用され,日常臨床で広く使用されている。しかしながら,IgG-κ型多発性骨髄腫患者においてcomplete response (CR)などの深い奏効の治療効果判定を行う際にInternational Myeloma Working Group (IMWG)の基準に従い通常の免疫固定法を用いた場合は,血清中のdaratumumabがIgG-κとして検出されるため患者由来のIgG-κ型M蛋白と区別ができず,CRの判定(免疫固定法で検出なし)が正確に施行できない可能性がある。
そこで,治療薬として投与されたdaratumumabと反応する抗体試薬を用い,免疫固定法の判定への影響を防止する方法としてDaratumumab-Specific Immunofixation Reflex Assay (DIRA:ダラツムマブ特異的免疫固定反射測定)が開発された。Daratumumab投与中のIgG-κ型多発性骨髄腫患者においては,CRの評価やCRからの再発の評価の際にDIRAを用いることが推奨される(推奨度A, エビデンスレベルIa)。
文献
| 1) | Caillon H, et al. Overcoming the interference of daratumumab with immunofixation electrophoresis (IFE) using an industry-developed DIRA test: Hydrashift 2/4 Daratumumab. Blood 128 (22): 2063, 2016 |
| 2) | Van de Donk NWCJ, et al. CD38 antibodies in multiple myeloma: back to the future. Blood 131 (1): 13-29, 2018 |
|
再発難治性多発性骨髄腫に対するIsatuximab + Carfilzomib + Dexamethasone(Isa-Kd)療法 |
|
IsatuximabはCD38を認識するモノクローナル抗体薬であり,すでにIsatuximab + Pomalidomide + Dexamethasone (Isa-Pd)療法が再発・難治性多発性骨髄腫に対し保険適用されている。その後,1-3レジメンの前治療歴がある再発難治例を対象としてIsatuximab + Carfilzomib + Dexamethasone (Isa-Kd)療法とKd療法とのphase III比較試験が行われた1)。
Isatuximab(10 mg/kg点滴静注)はサイクル1では4週間毎週,サイクル2以降は隔週で投与された。Carfilzomibはサイクル1のday 1, 2は20 mg/m2が, day 8, 9, 15, 16は56 mg/m2が,サイクル2以降は56 mg/m2がday 1, 2, 8, 9, 15, 16に点滴静注された。Dexamethasoneは20 mgがday 1, 2, 8, 9, 15, 16, 22, 23に経口または静脈投与された。Isa-Kd群とKd群は3:2に無作為に割り付けられ,病勢進行または不耐容な有害事象の出現まで治療継続された。Isa-Kd群(179例),Kd群(123例)の前治療歴の中央値は2レジメンで,免疫調節薬抵抗例はそれぞれ44%と47%,プロテアソーム阻害薬抵抗例は31%と36%であった。無増悪生存期間の中央値は未到達 vs 19.15ヵ月とIsa-Kd群が有意に優れていた (HR, 0.53; 99%CI, 0.32-0.89; p=0.0007)。奏効率では,MRD陰性(<10-5)が30% vs 13% (p=0.0004), CRが40% vs 28%, VGPR以上の奏効は73% vs 56% (p=0.0011),PR以上の奏効は87% vs 83%とIsa-Kd群が優れていた。Grade 3以上の主な有害事象は貧血(22% vs 20%),好中球減少(19% vs 7%),血小板減少(30% vs 24%),肺炎(21% vs 14%)などであった。Isatuximabによる注入反応は全grade 46%であったが,grade 3以上は1%であった。重篤な有害事象は59% vs 57%で,死亡例は3% vs 3%であった。
これらの結果より,再発難治性多発性骨髄腫に対するIsa-Kd療法は有用な治療法として推奨される(推奨度A,エビデンスレベル 1b)。
文献
| 1) | Moreau P, et al. Isatuximab, carfilzomib, and dexamethasone in relapsed multiple myeloma (IKEMA): a multicentre, open-label, randomised phase 3 trial. Lancet 397:2361-2371, 2021 |
|
移植非適応多発性骨髄腫に対するixazomib維持療法 |
|
Ixazomibは経口の新規プロテアソーム阻害剤(PI)であり,日本においては2017年に「再発又は難治性の多発性骨髄腫」に対する薬剤,また2020年に「多発性骨髄腫における自家造血幹細胞移植後の維持療法」の薬剤として承認された。さらに,2021年に「幹細胞移植歴のない多発性骨髄腫における維持療法」の薬剤としても承認された。
今回の承認は,多施設共同国際臨床第III相試験(TOURMALINE-MM4)の結果に基づくものである1)。同試験では,自家移植歴のない成人多発性骨髄腫患者をixazomib単剤投与(n=425)とプラセボ群(n=281)にランダムに割付けた。ixazomibもしくはプラセボ (第1, 8, 15日/1サイクル28日間)投与を24ヶ月間持続し,ixazomibの有効性と安全性を比較検証した。プライマリーエンドポイントである無増悪生存期間中央値は,ixazomib群で17.4ヶ月,プラセボ群で9.4ヶ月となり,ixazomib群で進行と死亡のリスクを34%減少させた(HR, 0.659; 95%CI, 0.542-0.801; P<0.001)。グレード3以上の治療に起因する有害事象(treatment-emergent adverse events: TEAEs)は,ixazomib群で36.6%, プレセボ群で23.2%であった。比較的頻回に認められたTEAEs(すべてのグレード; ixazomib群 vs プラセボ群)は,嘔気 (26.8% vs 8.0%),嘔吐(24.2% vs 4.3%),下痢(23.2% vs 12.3%)で,また2次がん (5.2% vs 6.2%)についてはixazomib投与による増加は認められなかった。
Ixazomibは多発性骨髄腫における維持療法の効能を有する初めての経口PIであり,再発を遅らせることが期待できる治療選択肢の一つである(推奨度A,エビデンスレベル 1b)。
文献
| 1) | Dimopoulos MA, et al. Ixazomib as postinduction maintenance for patients with newly diagnosed multiple myeloma not undergoing autologous stem cell transplantation: the phase III TOURMALINE-MM4 trial. J Clin Oncol 38:4030-4041, 2020 |
|
再発難治性多発性骨髄腫に対するDaratumumab + Carfilzomib+ Dexamethasone(Dara-Kd)療法 |
|
Daratumumab(点滴静注)+ Carfilzomib + Dexamethasone (Dara-Kd)療法においては, 再発難治性多発性骨髄腫85例を対象としたPhase Ib試験が行われた1)。10例は初回投与としてdaratumumab 16 mg/kgをcycle 1のday 1に, 75例は初回投与としてdaratumumab 8 mg/kgをcycle 1のday 1, 2に施行した。年齢38-85歳(中央値66歳), 前治療レジメン数は1-4 (中央値2)で, lenalidomide抵抗性60%, pomalidomide抵抗性13%, bortezomib抵抗性31%, PIとIMiDsの両者抵抗性29%含まれていた。評価可能であった82例において全奏効率(部分奏効以上)は84%であり,全症例の12か月無増悪生存率は74%であった。Grade 3以上の有害事象は, 血小板減少(31%), リンパ球減少(24%), 貧血(21%), 好中球減少(21%)などであった。Daratumumabの注入反応は,16 mg/kg 1回投与群が60%, 8 mg/kg 2回投与群が43%であった。
Dara-Kd療法の有効性をさらに検証すべく,再発難治性多発性骨髄腫466名を対象に,Kd療法と比較した多施設共同無作為化非盲検第Ⅲ相試験(CANDOR)が行われた2)。1レジメン以上の前治療歴があり,これまでの治療に部分奏効以上の効果が得られた再発難治性多発性骨髄腫466名を対象に,Dara-Kd群とKd群を2:1に割り付けて試験を行った。Dara-Kd群312名,Kd群154名が登録され,年齢中央値はそれぞれ64歳と64.5歳であり,高リスク染色体異常を有する患者は15%と17%, bortezomib抵抗性の患者は32%と36%, lenalidomide抵抗性の患者は28%と31%それぞれ含まれていた。Carfilzomib(30分点滴静注)は,1サイクル目のday1,2に20 mg/m2を投与し,以降は56 mg/m2を投与した。Daratumumab(点滴静注)は,1サイクル目は8 mg/kgをday 1,2に投与し,day 8以降は16 mg/kgを投与した。観察期間の中央値17.8か月で,有効性をDara-Kd群とKd群で比較したところ,無増悪生存期間(中央値)は未到達 vs 15.8か月(HR, 0.63; 95%CI, 0.46-0.85; p=0.0027),全奏効率(部分奏効以上)は84% vs 75%,MRD陰性率(<10-5)は13% vs 1%といずれもDara-Kd群が有意に優れていた。Grade 3以上の有害事象はDara-Kd群82%, Kd群74%であり,Dara-Kd群でKd群より2%以上多く認められた有害事象として,血小板減少,高血圧,好中球減少,貧血,倦怠感,肺炎,インフルエンザ感染症,敗血症,下痢などが挙げられた。しかし,有害事象により治療を中断した割合は2群間で類似していた(Dara-Kd群22% vs Kd群25%)。
これらの結果から,再発難治性多発性骨髄腫に対するDara-Kd療法は有用かつ忍容性の高い治療法として推奨される(推奨度A,エビデンスレベル 1b)。
文献
| 1) | Chiari A, et al. Daratumumab plus carfilzomib and dexamethasone in patients with relapsed or refractory multiple myeloma. Blood 134:421-431, 2019 |
| 2) | Dimopoulous M, et al. Carfilzomib, dexamethasone, and daratumumab versus carfilzomib and dexamethasone for patients with relapsed or refractory multiple myeloma (CANDOR): results from a randomised, multicentre, open-label, phase 3 study. Lancet 396:186–97, 2020 |
|
再発難治性多発性骨髄腫に対するDaratumumab + Pomalidomide + Dexamethasone(Dara-Pd)療法 |
|
Daratumumab(点滴静注)+ Pomalidomide + Dexamethasone (Dara-Pd)療法においては,直前の治療に抵抗性であった103例[前治療レジメン数1-13 (中央値4)]を対象としたPhase Ib試験が行われた1)。全奏効率は60%で,CR以上の奏効例で29%にMRD陰性(<10-5)が得られた。無増悪生存期間の中央値は8.8ヵ月,全生存期間の中央値は17.5ヵ月であった。Grade 3以上の有害事象は,好中球減少(77%),貧血(28%),白血球減少(24%),血小板減少(19%)などであった。Daratumumabの注入反応は50%に認められたが,grade 3は4%であった。
Lenalidomide治療後の再発および抵抗性の112例を対象としたPhase II試験では,全奏効率は77.7%であり,lenalidomide抵抗例における全奏効率は76.2%であった2)。Grade 3以上の有害事象は好中球減少(62.5%),貧血(17.9%),血小板減少(12.5%),感染症(31.3%),肺炎(13.4%)などであった。Daratumumabの注入反応は30.4%に認められた。
1レジメン以上の前治療歴があり,これまでの治療に部分奏効以上の効果が得られた例を対象に,Dara-Pd療法とPd療法とのphase III比較試験が行われた3)。Daratumumabは1800 mg皮下注(一部16 mg/kg点滴静注)がサイクル1-2は毎週,サイクル3-6は隔週,サイクル7以降は4週毎に投与された。Pomalidomideは4 mg/日がday 1-21に,dexamethasoneは40 mg(75歳以上の例では20 mg)が毎週1回投与された。Dara-Pd群(151例),Pd群(153例)の前治療歴の中央値は2レジメンで,lenalidomide抵抗例はそれぞれ79%と80%,プロテアソーム阻害剤抵抗例は47%と49%であった。無増悪生存期間の中央値は 12.4ヵ月 vs 6.9ヵ月とDara-Pd群が有意に優れていた (HR, 0.63; 95%CI, 0.47-0.85; p=0.0018)。この延長効果はlenalidomide抵抗例やプロテアソーム阻害剤抵抗例においても認められた。奏効率では,MRD陰性(<10-5)が9% vs 2%, CRが25% vs 4%, VGPR以上の奏効は51% vs 20%,PR以上の奏効は69% vs 46% (p<0.0001)とDara-Pd群が優れていた。Grade 3以上の主な有害事象は好中球減少(68% vs 51%),貧血(17% vs 21%),血小板減少(17% vs 18%),肺炎(11% vs 6%)などであった。Daratumumabによる注入反応は5%でgrade 1-2であった。有害事象による死亡は7% vs 7%であった。
これらの結果より,再発難治性多発性骨髄腫に対するDara-Pd療法は有用な治療法として推奨される(推奨度A,エビデンスレベル 1b)。
文献
| 1) | Chari A, et al. Daratumumab plus pomalidomide and dexamethasone in relapsed and/or refractory multiple myeloma. Blood 130: 974-981, 2017 |
| 2) | Siegel DS, et al. Pomalidomide, dexamethasone, and daratumumab in relapsed refractory multiple myeloma after lenalidomide treatment. Leukemia 34: 3286-3297, 2020 |
| 3) | Dimopoulos MA, et al. Daratumumab plus pomalidomide and dexamethasone versus pomalidomide and dexamethasone alone in previously treated multiple myeloma (APOLLO): an open-label, randomised, phase 3 trial. Lancet Oncol 22: 801-812, 2021 |
|
ALアミロイドーシスに対するdaratumumab + bortezomib + cyclophosphamide + dexamethasone (DCyBorD)療法 |
|
わが国ではALアミロイドーシスに対して承認を受けた薬剤はなく,これまではmelphalan (MEL) + dexamethasone (DEX)療法やbortezomib (BOR) + DEX療法、BOR + cyclophosphamide (CPA)+DEX (BCD)療法などが行われてきた。
CD38を標的としたモノクローナル抗体医薬であるDaratumumab (DARA)をBCD療法に上乗せして新規ALアミロイドーシス患者に投与する第III相試験が行われた(ANDROMEDA試験)1)。本試験でDARAは皮下注製剤が投与された。DARAの皮下注製剤は,再発または難治性の多発性骨髄腫に対してDARAを皮下注射するグループと点滴静注するグループに分け,全奏効率で評価した結果,点滴静注に対して非劣性が示された(COLUMBA試験)2)。
ANDROMEDA試験では、DARA+BCD (DCyBorD)療法群とBCD療法群に無作為に割り付けられ,主要評価項目である血液学的完全奏効はDCyBorD群で53.3%,BCD群で18.1%とDCyBorD群で有意に優れていた。血液学的増悪や主要臓器障害増悪をイベントとしたevent free survival (EFS)はDCyBorD群が有意に良好であった(HR, 0.58; 95%CI, 0.36-0.93; p=0.02)。6か月時点における心及び腎の臓器奏効もそれぞれ41.5% vs 22.2%及び53.0% vs 23.9%であり,いずれもDCyBorD群の方が高い奏効率を示した。主なGrade 3以上の有害事象は,リンパ球減少(13.0% vs 10.1%),肺炎(7.8% vs 4.3%),心不全(6.2% vs 4.8%),下痢(5.7% vs 3.7%)で,DARAの投与関連反応は7.3%の患者で認められた。
このように,BCD療法にDARAを上乗せしたDCyBorD療法は,高い血液学的完全奏効とEFSを示し,National Comprehensive Cancer Network (NCCN)ガイドライン(2021 version 2)では移植適応・非適応いずれの症例にも推奨されている(カテゴリー1)。わが国では2021年8月25日,DARA皮下注とBOR, CPA, DEXとの併用療法がDCyBorD療法として全身性ALアミロイドーシスに対する承認を取得した。新規ALアミロイドーシス患者に対するDCyBorD療法は,移植適応・非適応に関わらず推奨される(推奨度A エビデンスレベルIb)。
文献
| 1) | Kastritis E, et al. Daratumumab-based treatment for immunoglobulin light-chain amyloidosis. N Engl J Med. 385:46-58, 2021 |
| 2) | Mateos MA, et al. Subcutaneous versus intravenous daratumumab in patients with relapsed or refractory multiple myeloma (COLUMBA): a multicentre, open-label, non-inferiority, randomized, phase 3 trial. Lancet Haematol 7:e370-e380, 2020 |
|
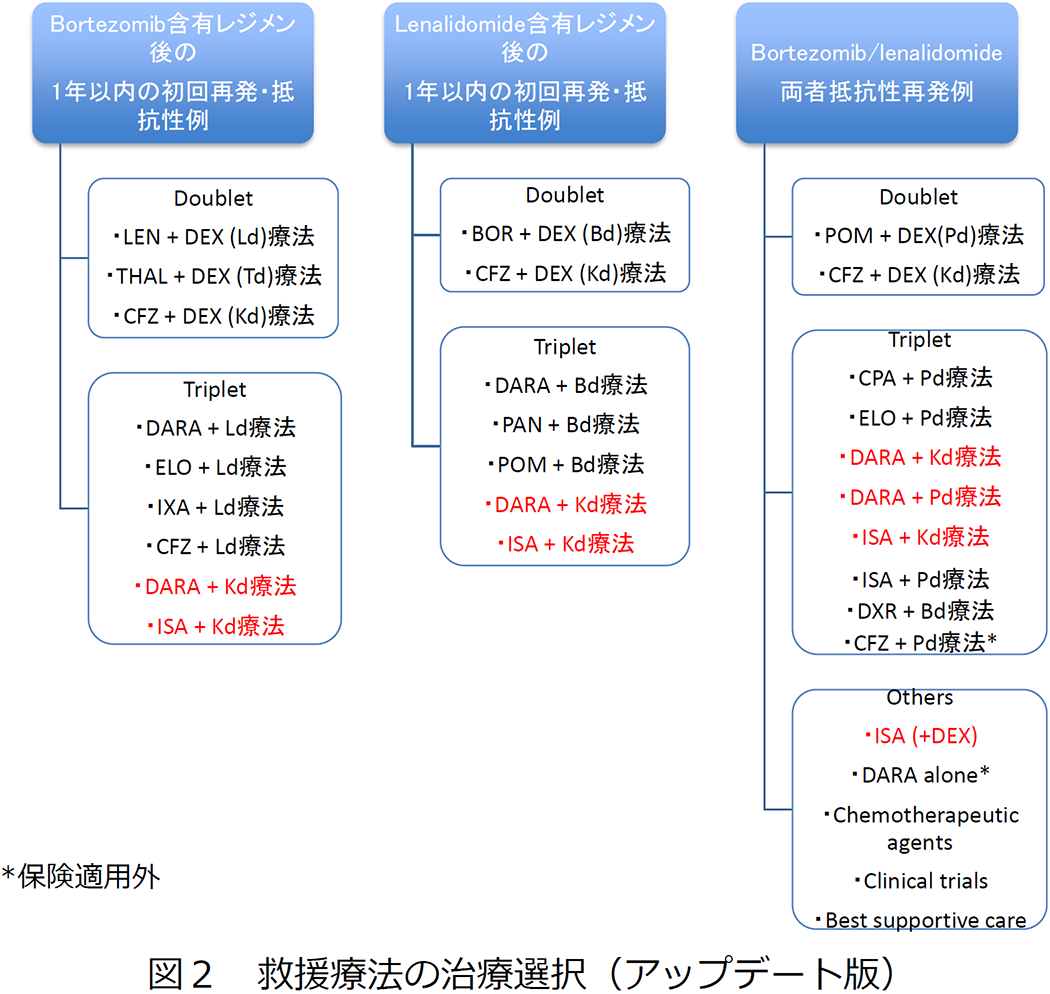
再発例のアルゴリズム(図2) |
 |
多発性骨髄腫診療の指針 第5版 |
| 日本で初めて出版された骨髄腫の診療ガイドライン |
 |
日本骨髄腫学会 編 B5 146頁
文光堂 定価 3,200円(税別)
ISBN978-4-8306-2061-4 |
多発性骨髄腫の診療指針、第5版が上梓された。日本骨髄腫学会編集による本診療指針は、2004年(平成16年)に第1版が発刊され、その後4年ごとに改訂を行ってきた。多くの関係者に手にとってご使用いただき、高い評価とともに多くのご意見をいただいた。現在も多発性骨髄腫領域の診断や治療の進歩は留まることがなく、臨床現場に最新の情報とエビデンスを届けるべく第5版を出版するに至った。
【改訂の経緯】
2003年にInternational Myeloma Working Group (IMWG: 国際骨髄腫作業部会)によって新たな形質細胞腫瘍の診断基準が提唱された。その後、International Staging System (ISS: 国際病期分類)の策定に日本骨髄腫研究会の貢献があり、IMWGからは統一治療効果判定基準を含め、国際的なエキスパートのコンセンサスを得た多くのガイドラインが纏められている。
20世紀末にサリドマイドの有効性が発見されて以降、免疫調節薬やプロテアソーム阻害薬の開発が進み、支持療法の進歩も加わり、多発性骨髄腫患者の予後は著しく改善した。日本骨髄腫学会における観察研究の結果においても、我が国の骨髄腫患者の生存期間中央値は1990年代の38.9ヶ月から2001〜2012年には60.6ヶ月と延長してきたことが示された。2014年にはIMWGによる新たな形質細胞腫瘍の診断基準が提唱され、並行してゲノム解析法の進歩による形質細胞腫瘍の分子病態、骨髄微小環境や免疫病態などに関する基礎研究の知見も蓄積されてきた。第4版以降は、2013年に発刊された日本血液学会造血器腫瘍診療ガイドラインとの整合性についても十分に配慮した。
第5版の発刊に先立ち、抗CD38単クローン性抗体薬が未治療の移植非適応骨髄腫患者に適応拡大され、標準治療が一変した。治療効果判定に関しても、完全奏効(Complete response: CR)はもとより微小残存腫瘍(Minimal residual disease: MRD)を日常診療で調べることができる時代となった。日常診療においてMRDの結果をどのように臨床応用するのかについては今後のエビデンスを待つ必要があるが、検査結果の解釈は重要である。またB-cell maturation antigen (BCMA)をはじめとした骨髄腫表面に発現する標的分子に対するキメラ抗原受容体導入T細胞(Chimeric antigen receptor-T cell: CAR-T)療法、二重特異性抗体や抗体薬剤複合体の開発も進んでおり、次期改訂までには日常診療に導入されることであろう。
このように多発性骨髄腫とその類縁疾患の診療は進歩の著しい領域であるが、第5版の作成にあたって編集委員会で取り決めた方針は、臨床現場で気軽に手にとって参照できるガイドラインにすることである。執筆担当者には、莫大な情報は図表で分かりやすくまとめていただき、診療指針が第4版よりも厚くならないようにご配慮いただいた。
【本書の活用法】
本書は、臨床試験から得られたエビデンスやエキスパートのコンセンサスに基づく現時点での骨髄腫診療の指針を呈示しているが、すべての臨床場面を含有するものではない。それぞれの局面での臨床的判断は担当医や診療チームに委ねられており、患者さんとご家族のご意向を十分に伺った上で治療方針を決定していただく必要がある。また第6版の発刊に至るまでの新たな情報については、本学会のホームページで提供させていただく予定である。
本診療指針が我が国の多発性骨髄腫の診療の質の向上に寄与し、多くの患者さんの診断と治療のお役に立てば幸いである。
令和2年11月
「多発性骨髄腫の診療指針 第5版」編集委員会
|
再発または難治性多発性骨髄腫に対するdaratumumab(ダラザレックス®)の使用について |
|
Daratumumab (DARA)は骨髄腫細胞に高発現しているCD38を標的とした新規モノクローナル抗体医薬であり,米国においては2015年に再発または難治性多発性骨髄腫に対する薬剤として承認されている。
再発難治例を対象としたDARAの第I/II相試験では,単独療法として8 mg/kgと16 mg/kgが投与され,PR以上の奏効割合は,それぞれ10%と36% (CR 5%,VGPR 5%を含む)であった1)。Grade 3以上の主な有害事象は肺炎と血小板減少であった。Infusion reactionはそれぞれ67%と71%と高頻度であったが,大部分はGrade 1, 2で主に初回投与時に認められた。
DARAの第III相試験では16 mg/kgが用いられ,lenalidomide (LEN) + dexamethasone (DEX)療法やbortezomib (BOR) + DEX療法との併用療法が検討された。DARA + LEN + DEX療法とLEN + DEX療法との比較試験(POLLUX)では,1年後のPFSはDARA群が83.2%でコントロール群の60.1%に対し有意に優れていた(p<0.001)2。PR以上の奏効割合は92.9% vs 76.4% (p<0.001), CR以上の奏効割合は43.2% vs 19.2% (p<0.001)とDARA群における深い奏効が認められた。Grade 3以上の主な有害事象は好中球減少51.9% vs 37.0%,血小板減少12.7% vs 13.5%,貧血12.4% vs 19.6%であった。DARAによるinfusion reactionは47.7%に認められたが,大部分はGrade 1, 2であった。DARA + BOR + DEX療法とBOR + DEX療法との比較試験(CASTOR)では,1年後のPFSはDARA群が60.7%でコントロール群の26.9%に対し有意に優れていた(p<0.001) 3。PR以上の奏効割合は82.9% vs 63.2% (p<0.001),CR以上の奏効割合は19.2% vs 9.0% (p=0.001)とDARA群における優位性が示された。Grade 3以上の主な有害事象は血小板減少45.3% vs 32.9%,貧血14.4% vs 16.0%,好中球減少12.8% vs 4.2%であった。DARAによるinfusion reactionは45.3%に認められたが,Grade 3は8.6%と少数であった。
このように,DARAは3剤療法として再発または難治性多発性骨髄腫に有効性の高い薬剤であり,National Comprehensive Cancer Network (NCCN)ガイドライン(2018 version 3)では既治療例に対するサルベージ療法としてDARA + LEN + DEX療法およびDARA + BOR + DEX療法が推奨されている(カテゴリー1)。わが国ではDARAは2017年11月に再発または難治性多発性骨髄腫を対象にDARA + LEN + DEX療法またはDARA + BOR + DEX療法として承認されており,再発難治例に対するこれらのレジメンは推奨される(推奨度A,エビデンスレベルIb)。なお,CD38は赤血球膜表面にも低発現していることから,DARAの投与を受けた患者では血清中のDARAが輸血検査用の赤血球と結合し,交差適合試験が偽陽性となることがあるため,投与前に輸血検査を実施するなどの対策が必要である4。
文献
| 1. | Lokhorst HM, et al: Targeting CD38 with daratumumab monotherapy in multiple myeloma. N Engl J Med 373:1207-1219, 2015 |
| 2. | Dimopoulos MA, et al: Daratumumab, Lenalidomide, and Dexamethasone for Multiple Myeloma. N Engl J Med 375:1319-1331, 2016 |
| 3. | Palumbo A, et al: Daratumumab, Bortezomib, and Dexamethasone for Multiple Myeloma. N Engl J Med 375:754-766, 2016 |
| 4. | van de Donk NW, et al: Clinical efficacy and management of monoclonal antibodies targeting CD38 and SLAMF7 in multiple myeloma. Blood 127:681-695, 2016 |
|
再発または難治性多発性骨髄腫に対するixazomib (ニンラーロ®)の使用について |
|
Ixazomibは経口の新規プロテアソーム阻害剤であり,米国においては2015年に再発または難治性多発性骨髄腫に対する薬剤として承認されている。
Ixazomibはlenalidomide, dexamethasoneとの併用において相乗効果をもたらすことから1),未治療例を対象とした ixazomib (第1, 8, 15日) + lenalidomide (25 mg/日, 第1-21日) + dexamethasone (40 mg/日, 第1, 8, 15, 22日) の3剤療法の第I/II相試験が実施され,PR以上の奏効は92%,VGPR以上の奏効は58%であった2)。
再発・難治例を対象としたixazomib (4 mg/body) + lenalidomide + dexamethasone療法はプラセボ + lenalidomide + dexamethasone群との第III相二重盲検比較試験として実施され(TOURMALINE-MM1),無増悪生存期間の中央値は20.6ヵ月 vs 14.7ヵ月(p=0.01),PR以上の奏効率は78% vs 72% (p=0.04),CR率は12% vs 7% (p=0.02)とixazomib群が有意に優れていた3)。主な有害事象としてはグレード3以上では好中球減少(23% vs 24%)と血小板減少(19% vs 9%),全グレードでは皮疹(36% vs 23%)と末梢神経障害(27% vs 22%)であった。
わが国における再発・難治例を対象とした第I相試験では,ixazomib (4 mg/body)単剤療法と3剤療法が実施された4)。薬物動態ではlenalidomideとdexamethasoneの併用による影響は少なく,最高血中濃度到達時間は1.08-1.83時間,半減期は5.2-5.7日であった。なお,血中濃度は食事の影響を受けるため,食事の1時間前から食後2時間までの間の服用は避けることが肝要である。
中等度以上の肝障害を有する固形腫瘍患者におけるixazomibの薬物動態の検討では,非結合型AUC0-lastは正常者と比較し23-32%高値であったことから,3 mg/bodyからの開始が推奨されている5)。また,高度の腎障害(クレアチニン・クリアランス ‹30 ml/min)を有する例や血液透析患者においては,非結合型AUC0-lastは腎機能が正常な患者と比し38%高値であり,3 mg/bodyが推奨されている6)。Ixazomibは血液透析では除去されないことから,透析と関係なく投与が可能である6)。
Ixazomib + lenalidomide + dexamethasone療法はすべて経口剤からなる利便性の高いレジメンであり,National Comprehensive Cancer Network (NCCN) ガイドライン(2017 version 3)では既治療の多発性骨髄腫に対するサルベージ療法として推奨されており(カテゴリー1),移植適応および移植非適応の未治療多発性骨髄腫に対する初期治療(代替レジメン)としても記載されている7)。
わが国ではixazomibは2017年3月に再発または難治性の多発性骨髄腫を対象にlenalidomideおよびdexamethasoneとの3剤療法として承認を得ており,再発・難治性多発性骨髄腫に対する本レジメンは推奨される(推奨度A,エビデンスレベルIb)。
文献
| 1) | Chauhan D, et al: In vitro and in vivo selective antitumor activity of a novel orally bioavailable proteasome inhibitor MLN9708 against multiple myeloma cells. Clin Cancer Res 17:5311-5321, 2011 |
| 2) | Kumar SK, et al: Safety and tolerability of ixazomib, an oral proteasome inhibitor, in combination with lenalidomide and dexamethasone in patients with previously untreated multiple myeloma: an open-label phase 1/2 study. Lancet Oncol 15:1503-1512, 2014 |
| 3) | Moreau P, et al: Oral Ixazomib, Lenalidomide, and Dexamethasone for Multiple Myeloma. N Engl J Med 374:1621-1634, 2016 |
| 4) | Suzuki K, et al: Phase 1 study of ixazomib alone or combined with lenalidomide-dexamethasone in Japanese patients with relapsed/refractory multiple myeloma. Int J Hematol 105:445-452, 2017 |
| 5) | Gupta N, et al: Pharmacokinetics of ixazomib, an oral proteasome inhibitor, in solid tumour patients with moderate or severe hepatic impairment. Br J Clin Pharmacol 82:728-738, 2016 |
| 6) | Gupta N, et al: A pharmacokinetics and safety phase 1/1b study of oral ixazomib in patients with multiple myeloma and severe renal impairment or end-stage renal disease requiring haemodialysis. Br J Haematol 174:748-759, 2016 |
| 7) | Kumar SK, et al: Multiple Myeloma, Version 3.2017, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw 15:230-269, 2017 |
|
自家末梢血幹細胞採取におけるPlerixafor(モゾビル®)の使用について |
|
Plerixaforは可逆性のCXCR4のアンタゴニストであり、CXCR4とSDF-1の結合を阻害し幹細胞を骨髄から末梢血へ動員する作用をもつ。米国では2008年に非ホジキンリンパ腫、多発性骨髄腫における幹細胞動員にG-CSFと併用することが承認されている。
PlerixaforはG-CSFと併用した場合、その効果は投与後4-9時間でピークを迎え、長時間持続することが報告されている1)。
PlerixaforとG-CSFで動員された細胞はG-CSF単独で動員された場合と比較し、増殖周期の細胞、CD34+CD38-の未熟な前駆細胞、T細胞、B細胞、樹状細胞、NK細胞を多く含み、造血幹細胞におけるVLA-4とCXCR4の発現亢進と細胞接着、細胞運動性、細胞周期、抗アポトーシスに関する遺伝子発現の亢進が報告されている2, 3)。これらの特徴はG-CSF単独で動員された幹細胞に比べてPlerixaforで動員された幹細胞は骨髄再生と免疫再構築能が高いことを示唆している。
Plerixaforの第2相試験では、G-CSFとの併用によりG-CSF単独より幹細胞動員(≧5 x 106 CD34陽性細胞/kg)成功率が高く、アフェレーシス回数の減少がみられた4)。
多発性骨髄腫302例を対象とした第3相試験では、4回以下のアフェレーシスで2 x 106/kg以上のCD34陽性細胞を採取出来た患者の割合はPlerixafor + G-CSF群で95%、placebo + G-CSF群で88%であり、Plerixafor群で有意に高かった(p=0.031)5)。また、2回以下のアフェレーシスで6 x 106/kg以上のCD34陽性細胞を採取出来た患者の割合はPlerixafor + G-CSF群で72%、placebo + G-CSF群で34%であり、Plerixafor群で有意に高かった(p ‹ 0.001)。Plerixafor投与群で高頻度にみられた有害事象は消化器症状(下痢、悪心、嘔吐、腹部膨満感)、疲労感、注射部位の反応であり、本剤投与による死亡例の報告はなかった。
以上の結果より、American Society for Blood and Marrow Transplantationによるconsensus guideline and recommendationでは、多発性骨髄腫ではG-CSF 10-16μg/kg/dayによる動員は、前治療1回の症例、melphalan未使用あるいはlenalidomide 4サイクル未満の症例に限定され、上記以外の症例では末梢血CD34陽性細胞のモニタリングとPlerixaforの先制性的使用で多くの症例で幹細胞の採取が成功するとしている6)。
Plerixaforはわが国では2017年2月,自家末梢血幹細胞移植のための造血幹細胞の末梢血中への動員促進の目的で,G-CSF製剤との併用投与が承認されており,多発性骨髄腫患者においても動員が不十分な例には本剤の使用が推奨される(推奨度A,エビデンスレベルIb)。
文献
| 1. | Harvey RD, et al. Temporal changes in plerixafor administration and hematopoietic stem cell mobilization efficacy: results of a prospective clinical trial in multiple myeloma. Biol Blood Marrow Transplant. 19:1393-1395, 2013. |
| 2. | Larochelle A, et al. AMD3100 mobilizes hematopoietic stem cells with long-term repopulating capacity in nonhuman primates. Blood 107:3772-3778, 2006. |
| 3. | Fruehauf S, et al. A combination of granulocytecolony- stimulating factor (G-CSF) and plerixafor mobilizes more primitive peripheral blood progenitor cells than G-CSF alone: results of a European Phase II study. Cytotherapy 11:992-1001, 2009. |
| 4. | Flomenberg N, et al. The use of AMD3100 plus G-CSF for autologous hematopoietic progenitor cell mobilization is superior to G-CSF alone. Blood 106:1867–1874, 2005. |
| 5. | DiPersio JF, et al. Plerixafor and G-CSF versus placebo and G-CSF to mobilize hematopoietic stem cells for autologous stem cell transplantation in patients with multiple myeloma. Blood 113:5720–5726, 2009. |
| 6. | Giralt S, et al. Optimizing autologous stem cell mobilization strategies to improve patient outcomes: consensus guidelines and recommendations. Biol Blood Marrow Transplant 20:295-308, 2014. |
|
多発性骨髄腫の診療指針 第4版 が 9月4日に刊行されました。 |
多発性骨髄腫診療の指針 第4版 |
| 日本で初めて出版された骨髄腫の診療ガイドライン |
 |
日本骨髄腫学会 編 B5 176頁
文光堂 定価 3,200円(税別)
ISBN 978-4-8306- 2040-9 |
多発性骨髄腫の診療指針,第4版が上梓された.本診療指針の第1版は2004(平成16)年6月に,第2版は2008(平成20)年11月に、第3版は2012(平成24)年9月に刊行され,多くの関係者に評価された.その結果,販売数は2016(平成24)年6月の時点で,第1版7,700部,第2版は6,840部、第3版は8,280部に達した.
【改訂の経緯】
第1版では,それまで多くの基準が用いられていた多発性骨髄腫の診断基準として、2003年にInternational Myeloma Working Group(IMWG)が提唱した基準を推奨した。この後、IMWGの診断基準は国際的な標準として広まった。また、わが国の骨髄腫の臨床のエビデンスとして,日本骨髄腫研究会(当時)の関連施設1,380症例の臨床成績を提示し,このデータを含めIMWGにより提案されたアルブミン値とβ2ミクログロブリン値に基づくInternational Staging Systemを紹介した.治療に関しては、治療開始時期を明示し,65歳以下の初期治療では自家骨髄移植を伴う大量化学療法(HDT–ASCT)を第一選択として推奨し,わが国の保険診療で可能な薬剤による骨髄腫の標準的治療のアルゴリズムを提唱し,さらに補助療法の重要性を示した.
第2版では,第1版以後の急速な骨髄腫研究の進歩に関する追加記述とともに,治療法について,推奨の程度とエビデンスレベルを明示した.また,当時,欧米では広く使われるようになっていたがわが国では保険診療で初回治療薬としては認められなかった新規薬剤のサリドマイド(THAL),ボルテゾミブ(BOR),レナリドミド(LEN)に関する欧米の成績と投与法を詳述した.さらに,項目の冒頭に要点または推奨を示して内容を分かりやすくし、理解すべき用語は用語解説として明示した.
第3版の編集方針は,1)第2版刊行以後さらに目覚ましく発展した骨髄腫診療の進歩を可能な限り網羅すること,2)新たに必須の検査となったfree light chainなどを理解しやすく詳述すること,3)新たにコラム欄を設けminimal residual disease,risk-adapted strategyや2次がんなどの最近のトピックスについて説明すること,4)最新の文献を引用すること,5)できるだけこの診療指針1冊で必要な内容が分かる自己完結を目指すこと、の5点であった。
また、2012年での標準的治療アルゴリズムを提案し、POEMS症候群とALアミロイドーシスについては類縁疾患として分けて詳述した。
【第4版の特徴】
今回の第4版の基本的な構成と記述様式は第3版と同じである。
編集方針と内容は、1)第3版以降の骨髄腫に関する新たな知見を可能な限り網羅する、2)IMWGの診断基準の改正や新規薬剤導入後の治療法の進歩を詳述する、3)THAL・BOR・LEN以後の新たな新薬を概説する、4)残存病変の評価、マクログロブリネミア、monoclonal gammopathy of renal significance (MGR)を増補する、5)2013年に公表された「日本血液学会造血器腫瘍診療ガイドライン」との相補性と整合性を高めること、の5点である。また、巻末に、我が国の骨髄腫に関する臨床基本データとして、日本骨髄腫学会が2013年に行った2001年―2011年の骨髄腫学会関連施設の2,234例の臨床所見と成績を1990年―2000年までの1,380例のデータと比較し、まとめた。
今回の指針で論議となったのは、IMWG2014診断基準改定で新たに多発性骨髄腫とされた、従来の(ウルトラ)ハイリスクSMMに対する治療開始時期の判断であった。編集委員の中にもいろいろな意見があり、3回のアンケートを実施するなど、編集委員間の討議を重ね第41回学術集会(於徳島)でも議論した。現時点でのとりまとめは指針に記したが、今後、エビデンスの蓄積によりこのまとめは見直される可能性がある。この点も含め、本指針の修正や訂正等は、適宜、日本骨髄腫学会のホームページ゙に掲載する方針である。
【本書の活用法】
本書は,現時点での骨髄腫診療の最新の知見と考え方を客観的かつ論理的に整理して提示しているが,すべての臨床の場面を包含するものではない.それぞれの局面での判断は担当医に委ねられている。また,骨髄腫診療の進歩が急速な現代にあっては,臨床成績がエビデンスとなり指針に取り入れられるまでには時間を要するので,骨髄腫診療の進歩の情報には常に注意を払うことをお願いしたい.
なお、本診療指針は、これまで日本骨髄腫研究会による編集であったが、平成24年4月に研究会が日本骨髄腫学会へ発展的に移行したため、今回から日本骨髄腫学会編となった。
平成28年8月
「多発性骨髄腫の診療指針,第4版」編集委員会
|
|